Este pez abre la puerta a una terapia génica que repara el corazón un infarto
Una característica especial regenerativa del genoma del pez cebra también puede funcionar también en el corazón de los mamíferos
R.I.
Madrid
Si algún día los seres humanos van a ser capaces de regenerar tejidos dañados del mismo modo que lo hacen los lagartos y los peces, será necesario un control preciso de la expresión génica en el tiempo y en el espacio; de lo contrario, podríamos ... acabar con células aleatorias creciendo por todas partes o con una nueva parte del cuerpo que nunca deja de crecer. Es decir, detener el proceso es tan importante como iniciarlo.
Ahora, un equipo de científicos de la Universidad de Duke (EE.UU.) que estudia cómo otros animales regeneran tejidos dañados ha dado un paso importante hacia el control de al menos una parte de la maquinaria regenerativa con ese tipo de precisión.
Los científicos emplearon los mecanismos de los que se sirve el pez cebra para reparar los daños sufridos por su corazón, combinados con los vectores víricos empleados para la terapia génica en humanos.
Una nueva terapia génica a la carta consigue tratar la epilepsia en ratones
C. G.La investigación abre una vía para tratar este trastorno en pacientes que no responden a los medicamentos anticonvulsivos
Tal y como detallen en un artículo en «Cell Stem Cell», los investigadores demuestran la capacidad de controlar la actividad génica en respuesta a una lesión, limitándola a una región específica del tejido y durante una ventana temporal definida, en lugar de estar continuamente activa en todo el órgano.
Para ello tomaron prestado un segmento de ADN de pez al que denominan TREE, elemento potenciador de la regeneración tisular. Los TREE son una familia de potenciadores génicos incluidos en el genoma que se encargan de detectar una lesión y orquestar la actividad de los genes relacionados con la reparación para la reconstrucción en un lugar específico. Estos potenciadores también pueden detener la actividad de los genes a medida que se completa la cicatrización. Estos elementos reguladores se han encontrado en moscas de la fruta, gusanos y ratones, así como en el pez cebra.
«Probablemente nosotros también los tengamos», afirma Ken Poss, Catedrático de Biología Regenerativa de la Facultad de Medicina de Duke, que descubrió la regeneración cardiaca en el pez cebra hace dos décadas y la ha estudiado desde entonces. «Pero nos resulta más fácil encontrarlos en el pez cebra y preguntarnos si funcionan en los mamíferos».
De unos 1.000 nucleótidos de longitud, estas secuencias potenciadoras están erizadas de sitios de reconocimiento para que diferentes factores y estímulos se adhieran y cambien la actividad de los genes. «No sabemos muy bien cómo lo hacen ni a qué responden realmente», explica Poss.
Los distintos tipos de células de un animal también tienen distintos tipos de potenciadores. «Algunos de ellos responden en múltiples tejidos, que son los que utilizamos aquí. Pero cuando perfilamos la regeneración de la médula espinal o las aletas de los peces, obtenemos secuencias diferentes. Puede haber decenas de miles de estos tipos de potenciadores en el genoma humano», añade.
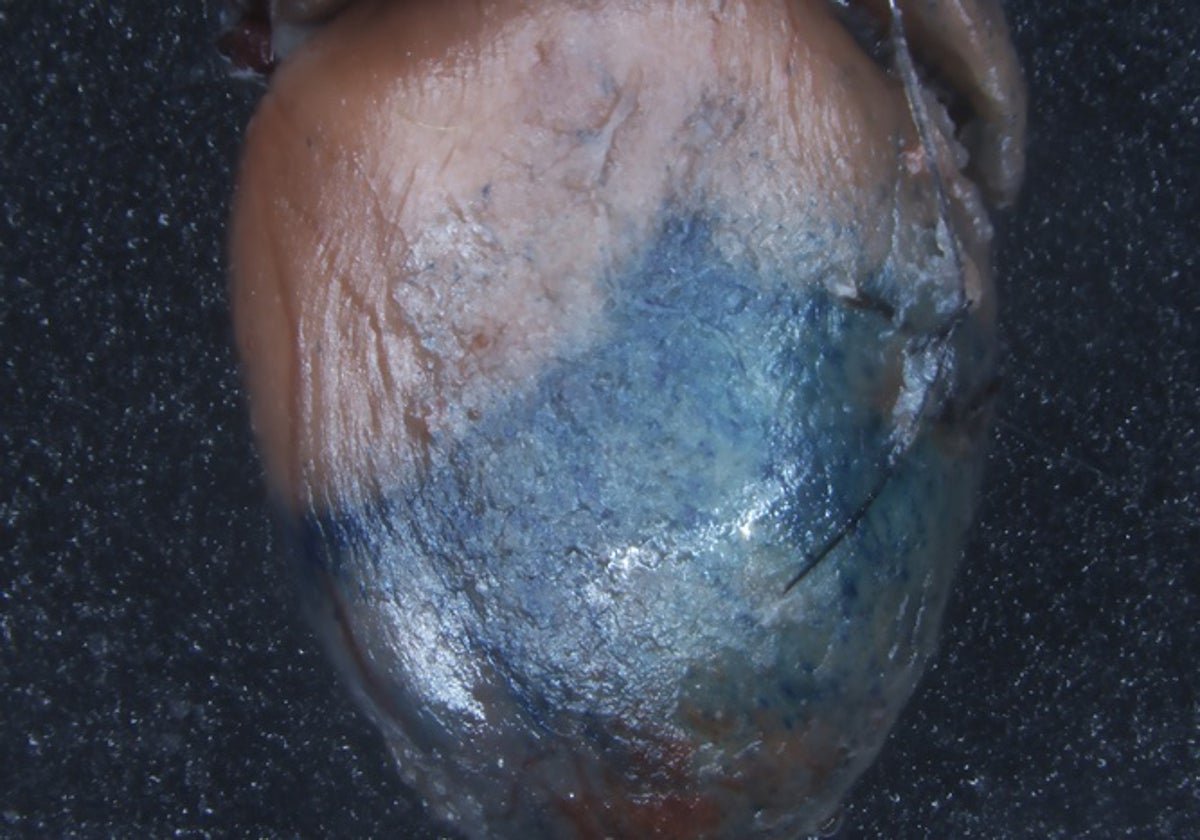
Como primer paso de este proyecto de seis años, los investigadores incorporaron varios tipos diferentes de TREEs de pez cebra a los genomas de ratones embrionarios. Utilizando un marcador visible para indicar la actividad de los genes, comprobaron que aproximadamente la mitad de los potenciadores funcionaban según lo previsto y volvían azul el tejido cuando y donde detectaban lesiones tisulares en los mamíferos transgénicos.
A continuación, quisieron saber si podían incorporar selectivamente los elementos potenciadores en un ratón adulto utilizando el virus adenoasociado, una herramienta familiar de terapia génica para introducir secuencias génicas en las células. El virus introducía ADN con un potenciador en todos los tejidos, pero la esperanza era que los TREE sólo se activaran en respuesta a una lesión.
Una serie de experimentos con ratones infartados demostraron que los virus que contenían un TREE podían infundirse una semana antes de la lesión y que el potenciador entraba en acción cuando detectaba la lesión. Pero descubrieron que también funcionaba cuando se introducía en el animal uno o dos días después del infarto. «Los tres TREE que probamos podían ser eficaces si se administraban un día o incluso más después de la lesión, ya que aún podían dirigir la expresión a la lesión», afirma Poss.
«¿Este método de administración de un TREE y un gen nos va a permitir administrar una carga molecular en el lugar y el momento adecuados? Hemos comprobado que sí en ratones», afirma Poss.
También liberaron por vía viral un TREE y un gen marcador fluorescente en cerdos, que tienen un corazón mucho más grande y una frecuencia cardiaca más parecida a la humana. Infundieron virus en los corazones de los cerdos a través de las arterias coronarias antes o después de un infarto y, de nuevo, el marcador sólo brilló en el lugar de la lesión.
A continuación, para comprobar si este sistema podía reparar realmente el daño, en lugar de limitarse a detectar el daño y activar un gen que ilumina el tejido, administraron una forma hiperactivada de YAP, un potente gen de crecimiento tisular implicado en el cáncer. La cuestión clave era saber si este «martillo realmente potente», capaz de desbocar la división celular, podría utilizarse sólo en el momento y lugar adecuados.
El tratamiento hizo que las células musculares empezaran a dividirse y que el corazón del ratón volviera a funcionar
Utilizaron un YAP mutado controlado por un TREE para ver si podían conseguir un crecimiento seguro del músculo tras un infarto en ratones. «El TREE activó un YAP mutado durante unas semanas, sólo en el lugar de la lesión, y luego suprimió su expresión de forma natural», explica Poss. El tratamiento hizo que las células musculares empezaran a dividirse y que el corazón del ratón volviera a funcionar casi con normalidad al cabo de varias semanas, aunque no sin algunas cicatrices.
«No sería deseable expresar YAP a pleno rendimiento, ya que puede causar problemas como un crecimiento excesivo, pero lo que descubrimos es que podíamos dirigirlo», explica Poss. «Todo el animal recibe la terapia génica, pero la carga YAP sólo se expresa a niveles mensurables cuando y donde se lesiona el corazón», añade. «Creemos que podemos utilizar estos métodos para controlar los genes en un momento y un espacio determinados, y eso incluye apagarlos».
La próxima tarea de los investigadores será comprender mejor qué moléculas se unen a los potenciadores, qué controla sus funciones y dónde están situados en el genoma humano, además de mejorar su capacidad de orientación.
«Lo importante son estos elementos de control», afirma Poss. «El pez cebra tiene en gran medida los mismos genes que nosotros, pero su capacidad para regenerar el corazón depende de cómo controle esos genes tras una lesión masiva».
Esta funcionalidad es sólo para suscriptores
Suscribete
Esta funcionalidad es sólo para registrados
Iniciar sesiónEsta funcionalidad es sólo para suscriptores
Suscribete