Esta molécula es clave para reparar un corazón dañado tras un infarto
Descubierto un nuevo mecanismo que funciona como un interruptor para impulsar la regeneración cardíaca
¿Se puede regenerar un corazón humano? La clave está en la comunicación entre genes
Logran reprogramar células del corazón a un estado fetal que impulsa su regeneración
R. I.
Madrid
La regeneración del corazón es uno de los mayores retos actuales de la investigación científica. Al contrario que otros animales, como la salamandra o el pez cebra, el ser humano es incapaz de regenerar sus tejidos y órganos pero los científicos no saben las causas. ... Mientras hay animales con una alta capacidad regenerativa de su miocardio dañado capaces de repararlo con nuevos cardiomiocitos, las células del músculo cardíaco, con capacidad de contraerse y responsables de los latidos del corazón, como es, por ejemplo, el caso del pez cebra, sin embargo, no sucede lo mismo con el corazón humano, incapaz de llevar a cabo dicha reparación de manera natural.
Por otro lado, las enfermedades cardiovasculares, como los ataques cardíacos, son una de las principales causas de muerte en todo el mundo debido a la limitada capacidad de autorregeneración del corazón. A diferencia de los humanos, los peces cebra tienen la notable capacidad de recuperarse de daños cardíacos.
Ahora, investigadores del grupo de Jeroen Bakkers, del Instituto Hubrecht (Países Bajos), trabajando con el pez cebra, han descubierto un nuevo mecanismo que funciona como un interruptor para impulsar la madurez de las células del músculo cardíaco en el proceso de regeneración.
«En 10 o 20 años podremos regenerar el corazón humano»
R. I.Elly Tanaka estudia la biología celular molecular de la regeneración de las extremidades y la médula espinal, así como la evolución de la regeneración
Dicho mecanismo, explican en un estudio que se publica en la revista «Science», se conserva evolutivamente, ya que se ha visto un efecto muy similar en células del músculo cardíaco de ratón y humano. Los resultados del estudio muestran que estos podría contribuir al desarrollo de nuevas terapias contra las enfermedades cardiovasculares.
Se estima que 18 millones de personas mueren cada año a causa de enfermedades cardiovasculares, y muchas de estas muertes están relacionadas con ataques cardíacos. En dicho evento, un trombo impide el suministro de nutrientes y oxígeno a partes del corazón.
Como resultado, las células del músculo cardíaco en la parte obstruida del corazón mueren, lo que puede provocar insuficiencia cardíaca en algunas ocasiones. Y, pesar de que existen terapias que controlan los síntomas, no hay tratamiento que pueda reemplazar el tejido perdido con células funcionales y maduras del músculo cardíaco, y así curar a los pacientes.
A diferencia de los humanos, algunas especies como el pez cebra pueden regenerar sus corazones. Se ha comprobado que dentro de los 90 días posteriores al daño, son capaces de restaurar completamente su función cardíaca. De esta forma, las células del músculo cardíaco sobrevivientes pueden dividirse y producir más células. Esta característica única proporciona a los corazones de pez cebra una fuente de nuevo tejido para reemplazar las células del músculo cardíaco perdidas.
Estudios anteriores identificaron con éxito factores que pueden estimular la división de las células del músculo cardíaco. Sin embargo, hasta ahora no se había analizado qué sucede con las células del músculo cardíaco recién formadas.
Se estima que 18 millones de personas mueren cada año a causa de enfermedades cardiovasculares, y muchas de estas muertes están relacionadas con ataques cardíacos
«No está claro cómo estas células dejan de dividirse y maduran lo suficiente como para contribuir a la función normal del corazón. Nos desconcertaba el hecho de que en los corazones de pez cebra, el tejido recién formado maduraba naturalmente e integraba sin problemas con el tejido cardíaco existente», asegura Phong Nguyen, primer autor del estudio.
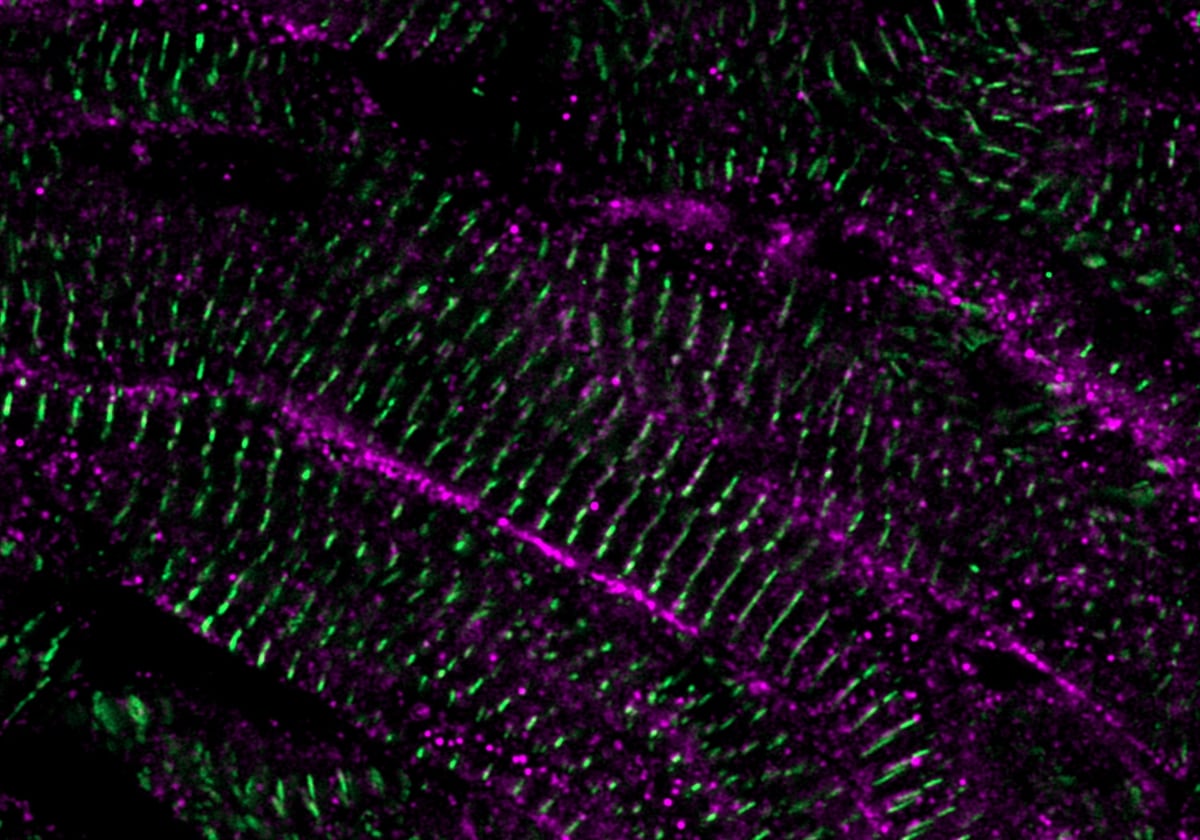
Para estudiar en detalle la maduración del tejido recién formado, los investigadores desarrollaron una técnica sofisticada que les permitió realizar imágenes en vivo del movimiento de calcio en las células del músculo cardíaco. La regulación del movimiento de calcio dentro y fuera de las células del músculo cardíaco es importante para controlar las contracciones cardíacas y puede predecir la madurez de la célula.
Así descubrieron que después de que las células del músculo cardíaco se dividen, los movimientos de calcio cambian con el tiempo. «El movimiento de calcio en la célula recién dividida era inicialmente muy similar al de las células del músculo cardíaco embrionarias, pero con el tiempo, las células del músculo cardíaco asumieron un tipo maduro de movimiento de calcio. Encontramos que la diada cardíaca, una estructura que ayudaba a mover el calcio dentro de la célula del músculo cardíaco, y específicamente uno de sus componentes, LRRC10, fue crucial para decidir si las células del músculo cardíaco se dividen o avanzan hacia la maduración. Las células del músculo cardíaco que carecían de LRRC10 continuaron dividiéndose y permanecieron inmaduras», dice Nguyen.
Después de establecer la importancia de LRRC10 para detener la división celular e iniciar la maduración de las células del músculo cardíaco de pez cebra, pasaron a probar si sus hallazgos podrían aplicarse a mamíferos. Para ello, indujeron la expresión de LRRC10 en células del músculo cardíaco de ratón y humanas cultivadas en laboratorio. Sorprendentemente, LRRC10 modificó el manejo del calcio, redujo la división celular y aumentó la maduración de estas células de manera similar a lo observado en corazones de pez cebra.
Los resultados del estudio muestran que LRRC10 tiene el potencial de impulsar la maduración de las células del músculo cardíaco a través del control de su manejo del calcio. Esto podría ayudar a resolver la falta de capacidad regenerativa del corazón de los mamíferos al trasplantar células del músculo cardíaco cultivadas en laboratorio en el corazón dañado.
No obstante, a pesar de que esta terapia potencial es prometedora, los resultados mostraron que estas células cultivadas en laboratorio aún son inmaduras y no pueden comunicarse adecuadamente con el resto del corazón, lo que lleva a contracciones anormales llamadas arritmias. «Aunque se necesita más investigación para definir precisamente cuán maduras están estas células del músculo cardíaco cultivadas en laboratorio cuando se tratan con LRRC10, es posible que el aumento de la maduración mejore su integración después del trasplante», explica Jeroen Bakkers, autor del estudio.
Bakkers añade que la mayoría de los modelos actuales de enfermedades cardíacas se basan con frecuencia en células del músculo cardíaco cultivadas en laboratorio que son inmaduras. «El 90% de los candidatos prometedores a fármacos encontrados en el laboratorio no llegan a la clínica, y la inmadurez de estas células podría ser un factor que contribuye a esta baja tasa de éxito. Nuestros resultados indican que LRRC10 podría mejorar la relevancia de estos modelos también».
Por lo tanto, concluyen, LRRC10 podría tener una contribución importante para generar células del músculo cardíaco cultivadas en laboratorio que representen de manera más precisa un corazón humano adulto típico, mejorando así las posibilidades de desarrollar nuevos tratamientos exitosos contra enfermedades cardiovasculares.
Esta funcionalidad es sólo para suscriptores
Suscribete


Esta funcionalidad es sólo para registrados
Iniciar sesiónEsta funcionalidad es sólo para suscriptores
Suscribete